Zprávy |
Akční nabídka |
Inzeráty |
Abnormální nidaci plodového vejce v jizvě po císařském řezu lze nejlépe diagnostikovat:
 |
Termíny v graviditě |
SAMOOBSLUHA:  |
Partneři:  |
|
|
Karcinom prsu - Standart léčebného plánu, adjuvantní chemoterapie u pacientek s |
|
Standard léčebného plánu
Karcinom prsu: adjuvantní chemoterapie u pacientek s pozitivním postižením
lymfatických uzlin stádia II.
|
Typ standardu |
Standard léčebného plánu |
|
|
|
Téma |
KLINICKÁ ONKOLOGIE |
kód 402 |
druh, třída 3,4 |
|
Součást tématu |
Karcinom prsu: adjuvantní chemoterapie u pacientek s pozitivním
postižením lymfatických uzlin stádia II. |
|
|
|
Skupina,
o kterou se pečuje |
Premenopauzální i postmenopauzální pacientky s různým rizikem
relapsu onemocnění. |
|
|
|
Určeno pro |
Onkology, radioterapeuty, chirurgy, gynekology |
Autor:
MUDr. R.Vyzula, CSc.
Oponent: Doc.MUDr. J. Žaloudík, CSc. |
|
|
Kritické výkony dle sazebníku |
42520, 42510, 43219, 43311 |
|
|
|
Personální a kvalifikační předpoklady |
Klinický onkolog s nadstavbovou atestací v oboru
Radioterapeut s nadstavbovou atestací v oboru
Chirurg a gynekolog se základní atestací v oboru |
|
|
|
Technické předpoklady |
Onkologická ambulance se stacionářem
Ozařovací technika |
|
|
|
Jiné předpoklady |
Návaznost na operační obory (chirurgie, gynekologie) |
|
|
|
Místo použití |
Klinická onkologie
Radioterapie |
|
|
VSTUP
|
Stanovení diagnózy |
- anamnéza
- stanovení diagnózy: mamografie, sonografie prsou, biopsie
- operační výkon
- histologické vyšetření + stanovení hormonálních receptorů
v nádorové tkáni
- stanovení TNM klasifikace /
staging
|
|
Indikace |
Kontraindikace |
|
Všechny ženy s karcinomem prsu a pozitivními lymfatickými uzlinami
stádia II (T0, N1, M0 nebo T1, N1, M0 nebo T2, N1, M0) a nutností
adjuvantní léčby. |
- Všechna ostatní stádia karcinomu prsu než je uvedeno
v indikacích.
- Pacientk| již léčeny v minulosti pro ca prsu.
- Zdravotní stav, který znemožňuje dodoržení stanoveného
postupu.
|
PROCES
|
Popis výkonu |
|
Viz algoritmus postupu |
VÝSTUPY
|
Standardně |
- časový rozvrh dispenzarizace pacientky
- zlepšení DFS (období bez onemocnění) a S (přežívání) pacientek
s ca prsu
|
VÝSLEDKY
|
Část standardu |
Kontrolní kritéria |
Způsob kontroly |
ANO/NE |
|
VSTUP |
Splnění podmínek k provedení vstupu |
chorobopis |
|
|
PROCES |
Stanovení strategie léčby |
chorobopis |
|
|
PROCES |
Provedení léčby |
chorobopis |
|
|
VÝSTUP |
Sledování pacientek |
chorobopis |
|
|
VÝSTUP |
zlepšení DFS (období bez onemocnění) a S (přežívání) pacientek
s ca prsu |
chorobopis |
|
|
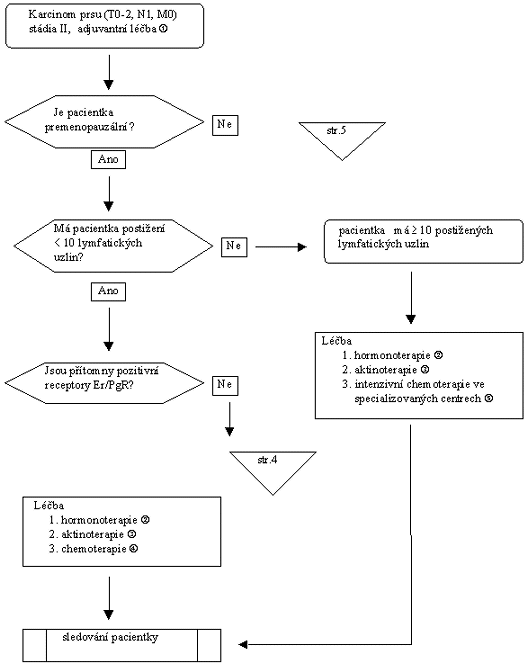
Karcinom prsu: adjuvantní chemoterapie u pacientek
s pozitivním postižením lymfatických uzlin stádia II. [vývojový
diagram 1, 2,
3,
4] |
|
Souhrn:
Karcinom prsu je trvale nejčastější maligní onemocnění u žen
s přibližně 20-ti% výskytem ze všech maligních nádorových onemocnění
žen. Přitom 1/3 jsou pacientky premenopauzální a 2/3 jsou
postmenopauzální. Řešení tohoto onemocnění vyžaduje komplexní přístup a
úzkou spolupráci několika medicínských oborů. Náročnost řešení léčby je
vidět na ne zcela jednotném přístupu v různých zemích, ale i v
různých onkologických centrech. Dosavadní vědecký vývoj vede k tomu,
že je naprosto nutné změnit některá dosavadní dogmata léčby. Jednou
z nejpalčivějších oblastí jsou změny v léčebném přístupu
k pacientkám s postiženými lymfatickými uzlinami stádia II, jak
v premenopauze, tak v postmenopauze. Komplexním standardizovaným
přístupem k léčbě těchto pacientek s karcinomem prsu dochází
v zahraničí poprvé ke snížení úmrtnosti.
Indikace:
Postup použijeme, splňují-li pacientky následující podmínky:
Pacientky s diagnózou karcinomu prsu, které absolvovaly staging a
léčebný chirurgický zákrok a vzhledem ke stádiu II s postiženými
lymfatickými uzlinami (T0, N1, M0 nebo T1, N1, M0 nebo T-2, N1, M0) mají
pokračovat v adjuvantní léčbě.
Kontraindikace:
Tento plán léčebného postupu by neměl být použit, pokud pacientka již
byla pro karcinom prsu léčena. Dále pak závažný zdravotní stav, který
znemožňuje dodržení stanoveného postupu. |
|
Výklad:
1. Pacientky absolvovaly staging onemocnění a chirurgický zákrok:
- Konzervativní operace s disekcí axilárních uzlin (lumpektomie /
segmentální mastektomie atd.) [1,2].
- Modifikovaná radikální mastektomie s disekcí axilárních uzlin
[2,3].
Adjuvantní léčba má začít do 6 týdnů od chirurgického zákroku. Doba
trvání adjuvantní chemoterapie nemá přesáhnout jeden rok. Rozdíl v
přežívání po podání 6 nebo 12 cyklů CMF nebyl prokázán [4].
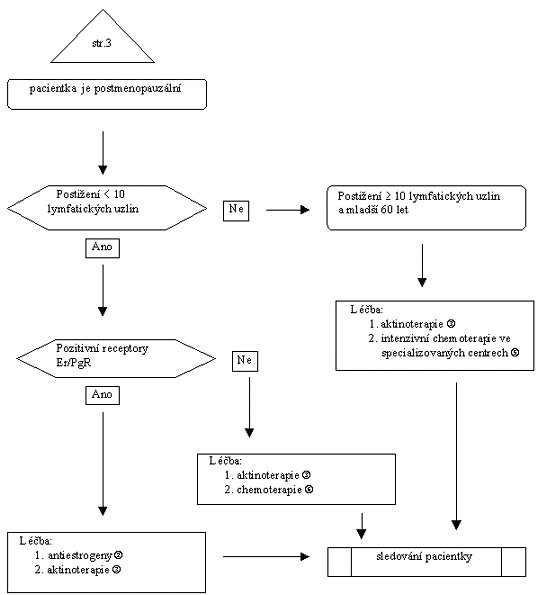
2. Doporučená hormonoterapie v I. fázi u premenopauzálních pacientek je
provedení ovariální ablace (analoga GnRH, radiační, chirurgická).
V našich podmínkách je optimální započat s analogy GnRH a
současně provést radiokastraci. Analaga GnRH je, v tomto případě,
nutné podávat nejméně 3x.
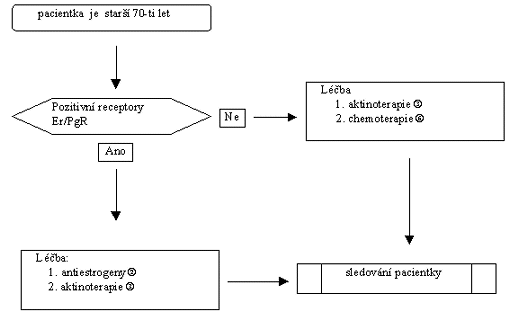
Doporučená hormonoterapie v I. fázi u postmenopauzálních pacientek je
podání antiestrogenu tamoxifenu. Tamoxifen podáván po dobu 5-ti let
prodlužuje jak dobu bez známek onemocnění, tak přežívání u pacientek
s pozitivními estrogenovými receptory [ 5] . Tato výhoda je více
patrná u postmenopauzálních než u premenopauzálních pacientek [ 5] .
Výhoda je rovněž výraznější pro pacienteky s pozitivními estrogenovými
receptory než s negativními [ 5] . Zároveň se výrazně snižuje vznik
kontralaterálního karcinomu prsu, a to o 39% [ 5-7] .
Nejvhodnější dávka tamoxifenu byla dle klinických studií stanopvena na
10 mg 2xD nebo 20 mg 1xD [ 8] . Podávání současně s chemoterapií nebo
po jejím skončení je stále nedořešenou otázkou, ale obě metody jsou
považována za přípustné.
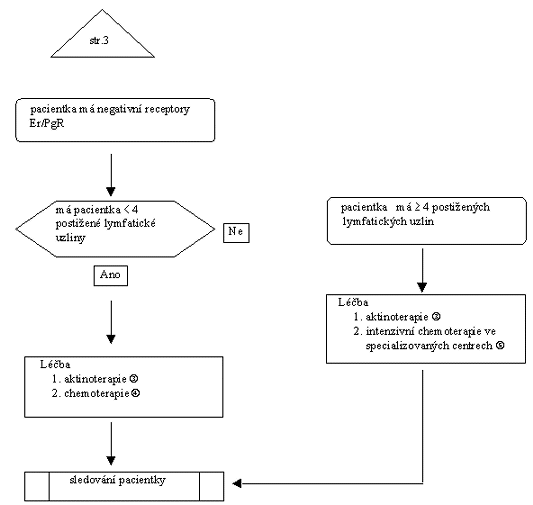
3. Riziko lokálního relapsu onemocnění po mastektomii je závislé na
přítomnosti a množství postižených axilárních uzlin [ 9] . U pacientek
s pozitivním postižením axilárních lymfatických uzlin se lokální
relaps vyskytuje ve 25% oproti 5% s negativním postižením [ 10] . Při
vzniku lokálního relapsu jen 50% odpovídá na léčbu [ 11] . Postoperativní
radioterapie po modifikované nebo radikální mastektomii by se neměla
podávat rutinně, avšak měla by být zvažována v případě známého
residuálního nádoru v operačním poli nebo v případě 4 nebo více
pozitivních axilárních uzlin z důvodu vyššího rizika lokoregionálního
relapsu onemocnění [4].
V případě konzervativní operace prsu pro karcinom je radioterapie
prováděna vždy.
Opožděná radioterapie o několik měsíců (2 - 7) následující po ukončení
adjuvantní chemoterapie po konzervativním chirurgickém zákroku je
doporučována pro pacientky s vysokým rizikem vzdálené diseminace
onemocnění [12]. U pacientek s 10 a více postiženými axilárními uzlinami
by se postoperativní radioterapie měla provádět pravidelně.
4. Premenopauzální nebo pacientky mladší 50-ti let mají o 1/3 méně
relapsů a o 1/4 méně úmrtí pokud dostávají adjuvantně chemoterapii [ 13] .
U postmenopauzálních pacientek jsou prozatímní údaje o účinku chemoterapie
kontraverzní a platí pro ně důležitost podávání tamoxifenu [ 14,15] .
Pro adjuvantní podání u stádia II, s pozitivním postižením
lymfatických uzlin, jsou doporučovány 3 cytostatické režimy:
cyklofosfamid/methotrexát/flurouracil (CMF) [16],
doxorubicin/cyklofosfamid (AC) [12] a
fluorouracil/doxorubicin/cyklofosfamid (FAC) [18]. Není jednoznačně
stanoveno, pro které pacientky, dle prognostických hledisek nebo
menopauzálního stavu, je nejvhodnější daný cytostatický režim [ 13]
. |
|
Doporučovaná cytostatická schémata:
CMF: cyklofosfamid/methotrexát/fluorouracil
cyklofosfamid 100 mg/m2 p.o. den 1-14
methotrexát 40 mg/m2 i.v. den 1
5-fluorouracil 600 mg/m2 i.v. den 1 a 8
cyklus 28 dní, omptimální počet cyklů 6
AC: cyklofosfamid/doxorubicin
cyklofosfamid 600 mg/m2 i.v. den 1
doxorubicin 60 mg/m2 i.v. den 1
cyklus 21 dní, optimální počet cyklů 4-6
FAC: cyklofosfamid/doxorubicin/fluorouracil
5-fluorouracil 500 mg/m2 i.v. den 1 a 8
doxorubicin 50 mg/m2 i.v. den 1
cyklofosfamid 500 mg/m2 i.v. den 1
cyklus 21 dní, optimální počet cyklů 4-6
5. Pacientky s více jak 10-ti postiženými lymfatickými uzlinami
relabují po standardní adjuvantní chemoterapii ve vysokém procentu
(70-90%) [ 19] . Retrospektivní analýzy výsledků a dávek chemoterapie
ukázaly, že v případě karcinomu prsu platí "více je lépe". Pacientky
s metastatickým onemocněním léčeny vyššími dávkami CMF měly delší
přežívání a lepší kvalitu života, než pacientky léčeny dávkami nižšími [
20] .Vzhledem k těmto okolnostem se nadále studuje vliv intenzivních
cytostatických režimů u rizikových pacientek stádia II a III
s pozitivními uzlinami [ 21-25] . Dosavadní výsledky klinických
studií jsou slibné, ale přesto podávání některého z publikovaných
režimů intenzivní léčby s nebo bez podpory kostní dřeně nebo
periferních kmenových buněk by mělo zůstat výlučně doménou
specializovaných onkologických center. Toxicita některých režimů je příliš
vysoká a vyžaduje si komplexní a dobře zorganizovaný tým zkušených
pracovníků.
6. Klinické studie prokazují skromnou, ale přece jistou výhodu podávání
chemoterapie u postmenopauzálních pacientek s pozitivním postižením
lymfatických uzlin. Celkové přežití po chemoterapii s doxorubicinem
(AC) a přidáním tamoxifenu je delší než po samotném tamoxifenu [ 26]
. |
Vývojový diagram 1
Vývojový diagram 2
Vývojový diagram 3
Vývojový diagram 4
|
Literatura:
- Fisher B, Anderson S, Redmond CK, et al.: Reanalysis and results
after 12 years of follow-up in a randomized clinical trial comparing
total mastectomy with lumpectomy with or without irradiation in the
treatment of breast cancer. N Engl J Med 1995;333 (22):1456-1461.
- Veronesi U, Salvadori B, Luini A, et al. Breast conservation is a
safe method in patients with small cancer of the breast: long-term
results of three randomised trials on 1,973 patients. Eur J Cancer 1995;
31A(10):1574-79.
- Fisher B, Redmond C, Fisher ER, et al. Ten-year results of a
randomized clinical trial comparing radical mastectomy and total
mastectomy with or without radiation. A Engl J Med 1985; 312(11):674-81.
- Velez-Garcia E, Carpenter JT, Moore M, et al. Postsurgical adjuvant
chemotherapy with or without radiotherapy in women with breast cancer
and positive axillary nodes: a Southeastern Cancer Study Group (SEG)
trial. Europ J Cancer 1992; 28A(11):1833-37.
- Early Breast Cancer Trialists Collaborative Group. Systemic
treatment of early breast cancer by hormonal, cytotoxic, or immune
therapy: 133 randomized trials involving 31000 recurrences and 24 000
deaths among 75 000 women. Lancet 1992;339(8785):1-15.
- Baum M, Brinkley DM, Dossett JA, et al. Controlled trial of
Tamoxifen as a single adjuvant agent in the management of early breast
cancer: analysis at eight years by Nolvadex Adjuvant Trial Organization.
Brit J Cancer 1988;57(6):608-11.
- National Institutes of Health Consensus Development Conference
statement: adjuvant chemotherapy for breast cancer. J Amer Med Assoc
1985;254(24):3461-63.
- Buzdar AU, Hortobabyi GN, Frye D et al. Bioequivalence of 20 mg
once-daily tamoxifen relative to 10 mg twice-daily tamoxifen regimens
for breast cancer. J Clin Oncol 1994;12:50-4.
- Harris J, Morrow M, Norton L. Malignant tumors of the breast. In
DeVita VT Jr, Hellman S, Rosenberg SA, editors. Cancer: principels &
practice of oncology, 5th Ed. Philadelphia: Lippincott-Raven
1997:1577.
- Cohen C, Gaumer J, DeRose P. Mammary Paget´s disease of the nipple.
Cancer 1961; 14:653.
- Bedwinck J, Lee J, Fineberg B. et al. Prognostic indicators in
patients with isolated local-regional recurrence of breast cancer.
Cancer 1981;47:2232.
- Fisher B, Brown AM, Dimitrov NV, et al. Two months of doxorubicin -
cyklofosfamid with and without interval reinduction therapy compared
with 6 months of cyklofosfamid, methotrexát, and fluorouracil in
positive-node breast cancer patients with Tamoxifen-nonresponsive
tumors: results from the NSABP B-15 [Prior Annotation Incorrect]. J
Clinic Oncol 1990;8(9):1483-96.
- Early Breast Cancer Trialists Collaborative Group. Systemic
treatment of early breast cancer by hormonal, cytotoxic, or immune
therapy: 133 randomized trials involving 31000 recurrences and 24000
deaths among 75 000 women. Lancet 1992;339(8785):71-85.
- Breast Cancer Trials Committee. Scotish Cancer Trials Office:
Adjuvant tamoxifen in the management of operable breast cancer: the
Scottish trial. Lancet 1987;2:171.
- Early Breast Cancer Trialists Collaborative Group. Effects of
adjuvant tamoxifen and of cytotoxic therapy on mortality in early breast
cancer: an overview of 61 randomized trials among 28 896 women. N Engl J
Med 1988;319:1681-92.
- Bonadonna G, Brusamolino E, Valagussa P, et al. Combination
chemotherapy as an adjuvant treatment in operable breast cancer. N Engl
J Med 1976;294(8):405-10.
- Buzdar AU, Kau SW, Smith TL, et al. Ten-year results of FAC adjuvant
chemotherapy trial in breast cancer. Am J Clinic Oncol 1989;12(2):123-8.
- Peters WP. High-dose chemotherapy and autologous bone marrow support
for breast cancer. In: DeVita VT, Hellman S., Rosenberg S.A., editors.
Important Advances in Oncology. Philadelphia: J.B. Lippincott
1991;135-50.
- Tannock IF, Boyd NF, DeBoer G. et al. A randomized trial of two dose
levels of cyclophosphamide, methotrexate, and fluorouracil chemotherapy
for patients with metastatic breast cancer. J Clin Oncol 1988;
6:1377-87.
- Levine M, et al. A clinical trial of intensive CEF versus CMF in
premenopausal women with node positive breast cancer. Proc ASCO 1995;
14:abstr.112.
- Fetting J, et al. CAF vs a 16 week multidrug regimen as adjuvant
therapy for receptor-negative, node positive breast cancer. Proc ASCO
1995; 14:abstr 83.
- Hryniuk W, Levine MN. Analysis of dose intensity for adjuvant
chemotherapy trials in stage II breast cancer. J Clinic Oncol
1986;4(8):1162-70.
- Peters WP. Cancer and Leukemia Group B: NCI HIGH PRIORITY CLINICAL
TRIAL --- Phase III Randomized Comparison of High-Dose Chemotherapy with
Autologous Marrow and Peripheral Stem Cell Support vs Standard-Dose
Chemotherapy Following Adjuvant Chemotherapy in Women with Stage II/IIIA
Breast Cancer with at Least 10 Positive Axillary Nodes, CLB-9082,
clinical trial, active, 01/20/91.
- Tallman MS. Eastern Cooperative Oncology Group: NCI HIGH PRIORITY
- CLINICAL TRIAL --- Phase III Randomized Study of Adjuvant CAF
(Cyklofosfamid / Doxorubicin / Fluorouracil) vs Adjuvant CAF Followed by
Intensification with High-Dose Cyklofosfamid / Thiotepa plus Autologous
Stem Cell Rescue in Women with Stage I/III Breast cancer at High Risk of
Recurrence, clinical trial, active, 08/07/91.
- Fisher B, Redmond C, Legault-Poisson S. et al. Postoperative
chemotherapy and tamoxifen compared with tamoxifen alone in the
treatment of positive-node breast cancer patients aged 50 years and
older with tumors responsive to tamoxifen: results from the National
Surgical Adjuvant Breast and Bowel Project B-16. J Clin Oncol
1990;8:1005-18.
|
Kompendium/Onkogynekologie/: Karcinom prsu - Standart léčebného plánu, adjuvantní chemoterapie u pacientek s
Napsáno dne Monday, 27. August 2001 @ 16:51:57 CEST |
| "Kompendium/Onkogynekologie/: Karcinom prsu - Standart léčebného plánu, adjuvantní chemoterapie u pacientek s" | 0 |
|
| | Za obsah komentáře zodpovídá jeho autor. |
|
| |

